Инсульты представляют собой одну из важнейших современных проблем медицины. Именно инсульты являются основной причиной длительной инвалидизации. По статистике, 85% людей, перенесших инсульт, нуждаются в интенсивном курсе восстановления функциональных изменений. Проще говоря, треть больных, не получивших должного медицинского обслуживания после инсульта, становится инвалидами. Чтобы этого избежать, необходимо незамедлительно обратиться за медицинской помощью и пройти курс лечения и реабилитации.
Первые три месяца после возникновения инсульта мышечный тонус нарастает в паретичных (парализованных) конечностях, появляется легкая спастичность мышц.
На данном этапе она не является патологией. Однако нарастание мышечного тонуса приводит к ярко выраженным приступам спазмов в мышцах и развитию их контрактур. Для полного восстановления больного необходимо снять спастичность мышц, иначе он не только потеряет трудоспособность, но и не сможет самостоятельно обслуживать себя в быту.
Лечение спастики после инсульта
Восстановление после инсульта невозможно без прекращения спастичности мышц. На первом этапе реабилитации применяется ряд упражнений для ее снижения: больного укладывают в различные позы, благодаря которым спазмы проходят. Эти упражнения могут проводиться только квалифицированным медицинским персоналом и в связке с физиолечением, к которому относятся парафиновое теплолечение, нанесение аппликаций и тому подобные манипуляции. Большое значение в работе по снижению спастичности мышц имеют мануальная терапия, гимнастика и медицинский массаж.
В некоторых случаях назначается хирургическое лечение спастичности мышц, при реабилитации после инсульта этот метод лечения практически не используется.
Спустя три месяца после инсульта спастичность мышц недопустима. Именно в это время важнейшую роль в восстановлении нормального функционирования конечностей приобретают миорелаксанты. С их помощью можно снизить тонус поперечнополосатой мускулатуры, уменьшив двигательную активность мышц, вплоть до полного нивелирования их сокращений. Миорелаксанты вводятся инъекционно в области проблемных конечностей. Определяет необходимость лечения препаратами только наблюдающий врач невропатолог и только по прошествии трех месяцев с момента возникновения инсульта.
Лечение Диспортом
Одним из эффективных миорелаксантов, использующихся в нашей стране, является Диспорт. Диспорт представляет собой ботулинический токсин типа А, применяющийся для снятия спастичности мышц у больных, которые после перенесенного инсульта страдают повышенным тонусом мышц без контрактуры. У таких больных, как правило, наблюдаются мышечные спазмы, сопровождающиеся болью, а также нарушение двигательной функции конечностей.
Препарат Диспорт вводится внутримышечно в несколько инъекций.

Клинический эффект наступает только спустя некоторое время: от нескольких дней до 2 недель. Улучшение сохраняется до полугода. При этом большую важность имеет время введения инъекций. Лечение диспортом спустя год после инсульта не приведет к такому же эффекту, как лечение на ранних сроках. В этом случае легкий парез может сохраняться. Практические исследования диспорта доказали его высокую эффективность в лечении спастичности мышц руки после инсульта.
Компоненты Диспорта могут вызывать аллергию. К побочным эффектам относятся так же боли в месте инъекции и незначительные кожные высыпания. При введении диспорта в первый раз может наблюдаться общая слабость, при повторном курсе лечения, как правило, эти эффекты не наблюдаются.
Инъекции Диспорта в центре "Три сестры"
Назначать и проводить лечение Диспортом могут только квалифицированные врачи, имеющие опыт диагностики и лечения препаратом, а также прошедшие соответствующее обучение. Ни в коем случае нельзя делать инъекции у неопытного врача и без предварительного обследования. Важно знать, что побочных эффектов можно избежать при введении минимально эффективной дозы препарата.
В реабилитационном центре «Три сестры» препарат Диспорт применяется при лечении больных, проходящих курс восстановления после инсульта. Перед назначением Диспорта пациенты реабилитационного центра «Три сестры» проходят полное обследование с использованием новейшего оборудования. Специалисты центра имеют большой опыт лечения данным препаратом, регулярно проходят специализированные обучающие курсы в России и за рубежом и знают все нюансы его использования.
Как записаться на лечение
(8 800) 555 29 82 Бесплатный звонок по России
(+7 499) 755 77 75 Телефон горячей линии
Для цитирования:
Дамулин И.В. Спастичность после инсульта // РМЖ. 2005. №7. С. 501
Инсульт остается крайне важной медико–социальной проблемой, поскольку является одной из наиболее частых причин инвалидизации, в большинстве случаев связанной с двигательными нарушениями . У 80–90% больных в остром периоде инсульта выявляется гемипарез, остаточные явления перенесенного инсульта различной степени выраженности и характера отмечаются примерно у 2/3 больных. Почти 3/4 лиц с инсультом – в возрасте 65 лет и старше, при этом частота инсульта примерно на 20% выше у мужчин, чем у женщин.
Более чем у 50% пациентов имеется артериальная гипертензия, у 25% – сахарный диабет, почти у 25% – указание в анамнезе на перенесенный в прошлом инсульт. Помимо артериальной гипертензии и сахарного диабета, факторами риска развития инсульта являются поражения магистральных сосудов головного мозга, фибрилляция предсердий, курение, гиперлипидемия и повышенный уровень фибриногена. У лиц молодого возраста среди основных факторов риска развития инсульта следует отметить церебральные эмболии, травму экстракраниальных сосудов, васкулопатии различного генеза, нарушения коагулогических свойств крови, использование оральных контрацептивных препаратов, роды, наркоманию (особенно кокаиновую зависимость), а также заболевания, связанные с ВИЧ–инфицированием. Следует заметить, что кокаин приводит к цереброваскулярным нарушениям, воздействуя на артериальное давление и тонус сосудов, вызывая длительный вазоспазм, увеличивая синтез тромбоксана и повышая склонность тромбоцитов к тромбообразованию, при этом также увеличивается риск возникновения кардиогенных эмболий . Хроническое употребление кокаина приводит к церебральной атрофии и патологии белого вещества полушарий головного мозга . По данным методов функциональной нейровизуализации выявляются множественные зоны церебральной гипоперфузии . Довольно характерны для этой категории больных нарушения лобного типа, проявляющиеся, в частности, увеличением числа ошибок персеверативного типа при выполнении Висконсинского теста сортировки карточек . Васкулиты являются причиной лишь 3–5% инсультов у лиц моложе 50 лет . Заболеваемость церебральными васкулитами составляет 1–2 случая на 1 млн населения в год (для сравнения: системными васкулитами – 39 случаев) . Основным механизмом, приводящим к поражению нервной системы при васкулитах, является ишемия . Возникновение ишемии при воспалении стенки сосудов связано с тремя патогенетическими факторами: обструкцией сосудов, увеличением склонности к коагуляции крови, что обусловлено влиянием провоспалительных цитокинов на поверхность эндотелия и изменением сосудистого тонуса . Однако чаще при васкулитах поражаются сосуды висцеральных органов или сосуды, кровоснабжающие периферические нервы . Возможно, это обусловлено особенностями строения стенки церебральных сосудов (в частности, лимфоцитарная адгезия эндотелия церебральных сосудов меньше 5%, в других органах – 15–20%) и наличием гематоэнцефалического барьера .
Одним из серьезных осложнений перенесенного инсульта является спастичность в пораженных конечностях, которая отмечается почти у 65% больных, перенесших инсульт. У больных со спастичностью существенно возрастает риск падений и, соответственно, травматизации, нередко возникают контрактуры, болевые синдромы, пролежни, остеопороз, тазовые расстройства и тромбофлебиты. Непосредственной причиной летального исхода этой категории больных могут быть сердечно–сосудистые, легочные или почечные осложнения.
Под спастичностью понимается двигательное расстройство, которое характеризуется скорость–зависимым повышением тонических рефлексов растяжения в результате поражения верхнего мотонейрона . Клинически это проявляется повышенным мышечным сопротивлением, варьирующим по своей выраженности в зависимости от амплитуды и угловой скорости производимого пассивного движения. Характерным для спастичности признаком является феномен «складного ножа», когда при пассивном сгибании пораженной конечности выраженное в начале движения сопротивление мышцы внезапно сменяется ее сокращением в направлении производимого движения. Спастичность, как правило, сопровождается парезом и иной симптоматикой, характерной для поражения верхнего мотонейрона. Среди клинических признаков поражения верхнего мотонейрона выделяют т.н. «позитивные» и «негативные» симптомы, а также изменения спастически сокращенных мышц (табл. 1).
Сразу после развития инсульта мышечный тонус в паретичных конечностях чаще снижен, однако в течение 2–3 дней он повышается, приводя, в конечном счете, к характерной позе с повышением тонуса в аддукторах и флексорах руки и аддукторах и экстензорах ноги. Легкие изменения в двигательной сфере в виде некоторого снижения мышечной силы и оживления рефлексов могут отмечаться и на ипсилатеральной стороне. Повышение мышечного тонуса в паретичных конечностях может возникать не только по прошествии нескольких дней от начала заболевания, но и спустя более продолжительный период времени (через недели и даже месяцы) .
Выраженность клинических проявлений может варьировать в зависимости от локализации очага, объема пораженной ткани и длительности заболевания. Регуляция мышечного тонуса осуществляется под влиянием как центральной, так и периферической импульсации на a–мотонейроны спинного мозга. a–мотонейроны, которые иннервируют мышечные волокна, располагаются в области передних рогов спинного мозга. Афферентные импульсы от рецепторов в мышцах передаются к структурам спинного мозга по сенсорным волокнам. Сенсорные волокна заканчиваются на a–мотонейронах передних рогов (моносинаптические пути), а также на вставочных нейронах задних рогов спинного мозга, связанных, в свою очередь, с двигательными нейронами, иннервирующими мышцы–антагонисты (полисинаптические пути). В основе возникновения спастичности лежит нарушение тормозящих влияний супраспинальных отделов на спинальные двигательные и вставочные нейроны. При этом на спинальном уровне возникает нарушение баланса между процессами возбуждения и торможения, а также денервационная гиперчувствительность и нейрональный спраутинг. Высказывавшееся ранее предположение о селективной гиперактивности g–системы, как одном из ведущих патогенетических механизмов спастичности, достоверных экспериментальных подтверждений не нашло.
При длительно существующем пирамидном синдроме определенное влияние на повышение мышечного тонуса оказывают также изменения самих мышц (табл. 2).
Ряд из этих расстройств (изменение реакции на растяжение, нарушение быстрого расслабления мышечного волокна, нарушение реципрокного ингибирования, нарушение сократительных способностей мышцы вследствие изменения структуры мышечного волокна, вторичное возникновение боли и нарушение способности мышц–антагонистов оказывать сопротивление, сопоставимое с действием спастически измененных мышц) могут быть уменьшены при использовании методов хемоденервации мышц или введении препаратов ботулинического токсина. Однако снижение мышечной силы и увеличение латентного периода активации мышцы при подобном лечении могут нарастать .
Несмотря на то, что спастичность считается одним из характерных признаков поражения кортикоспинального пути, в основе ее возникновения лежит поражение экстрапирамидных двигательных путей. Важную роль в регуляции мышечного тонуса играют ретикулоспинальные и вестибулоспинальные нисходящие пути. Само по себе изолированное поражение пирамидных путей на уровне коры, ножек мозга, основания моста или пирамид продолговатого мозга не сопровождается повышением мышечного тонуса .
В реабилитационном периоде после инсульта вначале происходит восстановление движений в проксимальных отделах конечностей, затем – в дистальных. Обычно при инсульте соответствующей локализации слабость в верхних конечностях возникает раньше, чем слабость в нижних конечностях, и, как правило, восстановление нормальных двигательных функций в гемипаретичной руке происходит хуже, чем в ноге. Одним из объяснений этому является то, что функциональное восстановление в руке включает не только регресс мышечной слабости, но также восстановление способности к выполнению тонких скоординированных движений. В отличие от этого функциональное восстановление в ноге, что проявляется восстановлением ходьбы, может протекать даже при незначительном или умеренном нарастании мышечной силы. Кроме того, успех реабилитационных мероприятий в руке может быть в значительной мере ограничен из–за присоединения изменений в плечевом суставе и связанном с этим возникновением боли.
Существенно хуже прогноз восстановления двигательных функций в руке, если плегия отмечается сразу в начале заболевания, а также в случае, если через 4 недели от начала заболевания не происходит восстановления хватания рукой. Однако примерно у 9% больных с выраженным парезом в руке в остром периоде заболевания в последующем можно добиться удовлетворительного восстановления, а у 70% пациентов, у которых отмечается некоторое улучшение двигательных функций в течение первых 4 недель от начала заболевания, в последующем отмечается полное или значительное восстановление двигательных функций в руке. Считается, что если у пациента в течение первых 2 недель от начала инсульта отсутствуют активные движения в конечностях, то в дальнейшем полного регресса двигательных расстройств не будет . В случае самостоятельного полного восстановления утраченных двигательных функций длительность периода восстановления, как правило, не превышает 3 месяцев (обычно 1,5–2 месяца после инсульта), однако в ряде случаев некоторое улучшение может продолжаться до 6–12 месяцев и даже более длительный период времени.
Спастичность приводит к существенным функциональным расстройствам и нарушению качества жизни больных. Однако сама по себе спастичность не всегда требует лечения, а уменьшение повышенного мышечного тонуса не во всех случаях имеет позитивное значение для больного . Например, у ряда пациентов с выраженными парезами наличие спастичности в мышцах, анатомически и функционально препятствующих силе тяжести («антигравитационные» мышцы), может облегчать стояние и ходьбу. Кроме того, наличие повышенного мышечного тонуса может препятствовать развитию мышечных атрофий, отека мягких тканей и остеопороза, а также уменьшать риск развития тромбоза глубоких вен нижних конечностей. Показаниями для лечения спастичности являются лишь те случаи, когда вследствие повышенного тонуса мышц нарушается «функционирование, позиционирование или комфорт».
Основными задачами лечения являются не только уменьшение выраженности патологически повышенного тонуса мышц, но также снижение выраженности болевого синдрома, предотвращение развития контрактур, улучшение способности больного к самообслуживанию, облегчение проведения реабилитационных мероприятий. Поэтому, осматривая пациента со спастичностью, врач должен решить следующие задачи :
1. Выявить пациентов, являющихся кандидатами для проведения того или иного специфического метода антиспастической терапии.
2. Определить конкретный метод терапии, применение которого в плане восстановления двигательных функций может быть наиболее эффективным у данного больного (миорелаксанты, инъекции ботулинического токсина, местное введение фенола или алкоголя, дорсальная ризотомия).
3. Провести мониторинг динамики основных двигательных характеристик (мышечная сила, подвижность в суставах и т.д.) и функциональной активности больного (ходьба, способность к самообслуживанию, активность в обыденной жизни) на фоне терапии.
Таким образом, клиническая оценка спастичности должна проводиться не только с целью выявления пораженных мышц (или мышечных групп), но также для определения влияния существующей спастичности на все аспекты жизнедеятельности больного, включая способность к передвижению, трудоспособность и активность в повседневной жизни, что важно для планирования терапевтических программ (табл. 3). Для более детальной оценки может использоваться электромиография, а также диагностические локальные блокады с анестетиком, что помогает в выборе последующего метода лечения.
Оценивая повышение мышечного тонуса, следует учитывать и то, что он может существенно меняться в зависимости от позы больного и его эмоционального состояния . Усиление выраженности спастичности может происходить под влиянием внутренних факторов (при задержке мочеиспускания, воспалительных урологических заболеваниях, мочекаменной болезни, запорах) и внешних причин (переломы, неправильное положение спастической конечности в постели, тромбоз глубоких вен нижних конечностей).
Следует особо подчеркнуть, что спастичность клинически реализуется в различной форме и с участием разных механизмов, включая изменения как пресинаптического, так и постсинаптического торможения . Поэтому универсального, одинаково эффективного при всех вариантах спастического синдрома, метода лечения не существует. Однако поскольку в основе непосредственного повышения мышечного тонуса лежит патологическое усиление полисинаптических рефлексов и возбуждение спинальных мотонейронов, важным направлением медикаментозной терапии является воздействие на эти структуры .
При спастичности используются следующие методы лечения: физиотерапия и лечебная гимнастика, пероральный прием миорелаксантов, инъекции препаратов ботулинического токсина, интратекальное введение баклофена с помощью помпы, хемоденервация (фенол, алкоголизация), а также операции на сухожилиях, суставах и ризотомия. Первые три из них в настоящее время получили наиболее широкое распространение.
Физиотерапевтические методы и лечебная гимнастика наиболее эффективны в раннюю фазу возникновения спастичности и направлены на активацию естественных процессов восстановления. Ранее считалось, что одной из целей реабилитации больных, перенесших инсульт, является использование методик, в которых основной акцент делался на использовании непораженных конечностей с целью большей независимости пациентов в повседневной жизни. При этом на пораженные конечности сколько–нибудь значительная нагрузка не оказывалась. В настоящее время доказано, что активизация пораженных конечностей непосредственно влияет на процессы функциональной церебральной реорганизации и таким образом способствует лучшему восстановлению неврологического дефекта. Кроме того, чрезмерное использование больными с гемиплегией непораженных конечностей может привести к такому нежелательному явлению, как повышение тонуса в гемипаретичных конечностях . Широко используется лечение положением, тепловые и холодовые процедуры, фонофорез, чрескожная электростимуляция нервов и др. С помощью этих методик удается не только снизить повышенный мышечный тонус, но и увеличить объем движений в суставах, а также предотвратить возникновение контрактур. Все это в конечном итоге приводит к повышению функциональной активности больных. К сожалению, положительный эффект этих методов терапии, как правило, носит непродолжительный характер. К тому же до настоящего времени сколь–либо доказательные контролируемые исследования по изучению эффективности этих методик отсутствуют.
Использование препаратов ботулинического токсина более оправдано в ситуациях, когда мышечный спазм носит преимущественно локальный характер. Длительность эффекта определяется дозой введенного препарата, размером мышцы, активностью мышцы и еще рядом факторов, в том числе одновременным проведением физиотерапевтических процедур. Эффект от введения препарата сохраняется в среднем 2–6 мес. У некоторых больных может отмечаться исчезновение положительного эффекта после повторных инъекций ботулотоксина . Наиболее частыми причинами этого является неправильный выбор мышцы, в которую вводится препарат, или неадекватные дозы ботулотоксина. Однако у некоторых больных (менее 10%) может быть истинное отсутствие эффекта. Считается, что в основе этого может лежать блокирование антителами ботулотоксина типа А, однако результаты иммунологических методов исследования противоречивы . Следует заметить, что использование препаратов ботулинического токсина в значительной мере ограничено из–за их высокой стоимости.
В практической деятельности наиболее широко используются миорелаксанты – баклофен, тизанидин (Сирдалуд), диазепам, дантролен, толперизон . Среди препаратов этой группы Сирдалуд занимает особое место, что связано с механизмом его действия и клиническим эффектом. Являясь центральным a2–адренергическим агонистом, Сирдалуд обладает стимулирующим действием на моноаминергические ядра ствола головного мозга. Это приводит к торможению спинальных мотонейронов, связанных афферентными волокнами II типа со стволовыми центрами, и соответственно – к снижению мышечного тонуса. При этом уменьшается выброс возбуждающих аминокислот из вставочных спинальных нейронов. Нисходящие адренергические супраспинальные пути играют значительную роль в регуляции мышечного тонуса . Анатомически эти пути тесно связаны со спинальными структурами, особенно с передними рогами, результаты физиологических исследований свидетельствуют об их участии в регулировании рефлекторных спинальных ответов . В спинном мозге большая часть a2–рецепторов располагается на вставочных нейронах, а не на мотонейронах. Являясь производным клонидина, Сирдалуд обладает высоким сродством к a2– и практически не действует на a1–адренергические рецепторы . Под действием Сирдалуда происходит торможение высвобождения из спинальных нейронов аспартата . Этот препарат селективно ингибирует через a2–адренорецепторы вставочные нейроны задних рогов спинного мозга, что лежит в основе его анальгезирующего эффекта .
Высказывается предположение о том, что дополнительный антиспастический эффект Сирдалуда обусловлен его влиянием на a2–рецепторы норадренергических нейронов, располагающихся в области голубого пятна и оказывающих влияние на спинальные структуры . Было выявлено, что действие Сирдалуда, также как и норадреналина, на адренорецепторы не меняется на фоне введения a1– и b–адренергических антагонистов или антагониста опиатных рецепторов налоксона. В эксперименте не было выявлено действия Сирдалуда на клетки Рэншоу . D. Coward , анализируя результаты экспериментальных и клинических исследований, подчеркивает, что антиноцицептивный эффект Сирдалуда носит самостоятельный характер и не связан с его миорелаксирующим действием.
На фоне действия Сирдалуда снижается лишь тонический компонент мышечного сокращения при сохранности фазической реакции . Это отлично от действия баклофена, снижающего тонический и фазический компоненты, что сопровождается снижением силы мышц.
Таким образом, антиспастический эффект Сирдалуда связывают с несколькими механизмами действия (пресинаптическое и постсинаптическое ингибирование вставочных нейронов, возможное влияние на глутаматергическую систему). Существенным моментом является то, что Сирдалуд не противопоказан при наличии у пациентов эпилептических припадков, что делает возможным его назначение больным с постинсультными спастическими парезами и судорожными припадками. Экспериментальные данные свидетельствуют о возможном противоэпилептическом эффекте высоких доз препарата, механизм которого остается неясным . Однако в качестве собственно противоэпилептического препарата Сирдалуд не используется.
Антиспастический эффект Сирдалуда примерно сопоставим с эффектом баклофена и диазепама. Однако Сирдалуд имеет по сравнению с этими препаратами немаловажные преимущества – лучшую переносимость и отсутствие существенного снижения мышечной силы . Последнее обстоятельство существенно ограничивает использование баклофена и диазепама, поскольку снижение мышечной силы может отмечаться как в паретичных, так и в интактных конечностях. Следует заметить, что более 10% больных, начавших принимать баклофен, вынуждены в последующем отказаться от его приема из–за нарастания мышечной слабости.
Сирдалуд широко используется для лечения спастичности различного генеза . Положительный антиспастический эффект препарата носит дозозависимый характер, что подтверждается параллельным определением уровня препарата в плазме крови . Подбор индивидуально эффективной дозы (от 2 мг до максимальной дозы 36 мг/сут.) обычно осуществляется в течение 2–4 недель. После перорального приема действие препарата проявляется уже через 30–45 минут, максимальный эффект наступает в течение 1–2 часов . Улучшение отмечается у 60–82% больных (для сравнения: на фоне приема баклофена – у 60–65%, диазепама – у 60–83%), при этом спастичность снижается в среднем на 21–37% (на фоне приема плацебо – на 4–9%) .
Важно заметить, что механизм действия Сирдалуда существенно отличен от механизмов действия других препаратов, используемых для снижения повышенного мышечного тонуса. Поэтому Сирдалуд применяется в ситуациях, когда отсутствует антиспастический эффект других антиспастических средств (при так называемых «не отвечающих на лечение» случаях). Кроме того, учитывая различия в механизмах действия, Сирдалуд и баклофен могут использоваться для лечения спастичности в комбинации.
Для Сирдалуда характерен гастропротективный эффект, происхождение которого остается до конца не выясненным. Данные экспериментальных и клинических исследований свидетельствуют о его способности предохранять слизистую желудка от действия нестероидных противовоспалительных препаратов. Механизм этого эффекта связывают с адренергической активностью, торможением выработки желудочного секрета и способностью предотвращать изменения гликопротеинов, обусловленные влиянием аспирина или индометацина.
Частота возникновения таких побочных реакций, как головокружение, сонливость, сухость во рту, общая слабость, коррелирует с уровнем препарата в плазме крови . На фоне назначения Сирдалуда может отмечаться легкое снижение артериального давления , что объясняется структурным сходством этого препарата с клонидином . На здоровых добровольцах было показано, что на фоне разового приема 6–12 мг Сирдалуда снижение артериального давления составляет в среднем 10–15% . В литературе упоминается возможность Сирдалуда потенцировать действие гипотензивных препаратов .
В единичных случаях возможно преходящее увеличение уровня печеночных ферментов, исчезающее после уменьшения дозы или отмены препарата, поэтому следует осторожно назначать Сирдалуд пациентам с печеночной или почечной недостаточностью. Препарат, как правило, хорошо переносится и при длительных курсах терапии.
Литература
1. Ворлоу Ч.П., Денис М.С., Ван Гейн Ж. и др. Инсульт. Практическое руководство для ведения больных. –СПб.: Политехника, 1998. –629 с.
2. Гехт А.Б., Бурд Г.С., Селихова М.В. и соавт. Нарушения мышечного тонуса и их лечение сирдалудом у больных в раннем восстановительном периоде ишемического инсульта. //Журн. невролог. и психиатр. –1998. –Т.98, №10. –С.22–29
3. Гусев Е.И., Гехт А.Б. Спастичность. //Русск. мед. журн. –1999. –Т.7, №12. –С.567–571
4. Дамулин И.В. Постинсультные двигательные расстройства. //Consilium Medicum. –2003. –Т.5, №2. –С.64–70
5. Дамулин И.В. Принципы реабилитации пациентов, перенесших инсульт. //Справочник практического врача. –2003. –№2. –С.21–24
6. Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. Нарушения кровообращения в головном и спинном мозге. /В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н.Н.Яхно, Д.Р.Штульмана. Т.1. –М.: Медицина, 2001. –С.231–302
7. Кадыков А.С. Миорелаксанты при реабилитации больных с постинсультными двигательными нарушениями. //Журн. невролог. и психиатр. –1997. –Т.97, №9. –С.53–55
8. Окнин В.Ю. Баклофен в неврологической практике. //Лечение нервных болезней. –2002. –№3. –С.34–36
9. Парфенов В.А. Лечение больных, перенесших инсульт. //Русск. мед. журн. –2001. –Т.9, №7–8. –С.306–309
10. Салихов И.Г., Богданов Э.И., Заббарова А.Т., Васильева А.В. Принципы диагностики церебральных васкулитов. –Казань: КГМУ, 2001. –27 с.
11. Behari M. Spastisity. //Neurology India. –2002. –Vol.50. –P.235–237
12. Benecke R. Spasticity/Spasms: Clinical aspects and treatment. //In: Motor disturbances I. Ed. by R.Benecke et al. –London etc.: Academic Press, 1987. –P.169–177
13. Benecke R. Botulinum toxin for spasms and spasticity in the lower extremities. //In: Therapy with Botulinum Toxin. Ed. by J.Jankovic, M.Hallet. –New York: Marcel Dekker, 1994. –P.557–565
14. Brin M.F. Botulinum toxin: chemistry, pharmacology, toxicity, and immunology. //Muscle & Nerve. –1997. –Vol.20, suppl.6. –P.S146–S168
15. Chen D.–F., Bianchetti M., Weisendanger M. Involvement of noradrenergic systems in the modulation of cutaneous reflexes. //In: Motor disturbances I. Ed. by R.Benecke et al. –London etc.: Academic Press, 1987. –P.179–186
16. Coward D.M. Tizanidine: Neuropharmacology and mechanism of action. //Neurology. –1994. –Vol.44., N.11 (Suppl.9). –P.S6–S11
17. Davies J. Selective depression of synaptic transmission of spinal neurons in the cat by a new centrally acting muscle relaxant, 5–chloro–4–(2–imidazolin– 2–yl–amino)– 1,3–benzothiodazole (DS103–282). //Brit. J. Pharmacol. –1982. –Vol.76. –P.473–481
18. Davies J., Johnston S.E. Inhibition by DS 103–282 of D–(3–H)–aspartate release from spinal cord slices. //Brit. J. Pharmacol. –1983. –Vol.78. –P.28–30
19. Davies J., Johnston S.E. Selective antinociceptive effects of tizanidine (DS 103–282), a centrally acting muscle relaxant, on dorsal horn neurons in the feline spinal cord. //Brit. J. Pharmacol. –1984. –Vol.82. –P.409–421
20. Davies J., Quinlan J.E. Selective inhibition of responses of feline dorsal horn neurons to noxious cutaneous stimuli by tizanidine (DS103–282) and noradrenalin: Involvement of alfa2–adrenoceptors. //Neurosci. –1985. –Vol.16. –P.673–676
21. Delwaide P.J., Olivier E. Pathophysiological aspects of spasticity in man. //In: Motor disturbances I. Ed. by R.Benecke et al. –London etc.: Academic Press, 1987. –P.153–167
22. Delwaide P.J., Pennisi G. Tizanidine and electrophysiologic analysis of spinal control mechanisms in humans with spasticity. //Neurology. –1994. –Vol.44., N.11 (Suppl.9). –P.S21–S28
23. Dietz V. Spastic movement disorder: what is the impact of research on clinical practice? //J. Neurol. Neurosurg. Psychiatry. –2003. –Vol.74. –P.820–821
24. Diez–Tejedor E., Frank A., Gutierrez M., Barreiro P. Encephalopathy and biopsy–proven cerebrovascular inflammatory changes in a cocaine abuser. //Eur. J. Neurol. –1998. –Vol.5. –P.103–107
25. Donaghy M. Toxic and environmental disorders of the nervous system. /In: Brain’s Diseases of the Nervous System. Tenth edition. Ed. by J.Walton. –Oxford etc.: Oxford University Press, 1993. –P.513–529
26. Enevoldson T.P. Recreational drugs and their neurological consequences. //J. Neurol. Neurosurg. Psychiatry. –2004. –Vol.75 (Suppl.3). –P.iii9–iii15
27. Filley C.M., Kleinschmidt–DeMasters B.K. Toxic leukoencephalopathy. //New Engl. J. Med. –2001. –Vol.345, N.6. –P. 425–432
28. Gormley M.E., O’Brien C.F., Yablon S.A. A clinical overview of treatment decisions in the management of spasticity. //Muscle & Nerve. –1997. –Vol.20, Suppl.6. –P.S14–S20
29. Gracies J.M., Nance P., Elovic E. et al. Traditional pharmacological treatments for spasticity. Part II: General and regional treatments. //Muscle & Nerve. –1997. –Vol.6 (Suppl.). –P.S92–S120
30. Groves L., Shellenberger M.K., Davis C.S. Tizanidine treatment of spasticity: a meta–analysis of controlled, double–blind, comparative studies with baclofen and diazepam. //Adv. Ther. –1998. –Vol.15, N.4. –P.241–251
31. Hassan N., McLellan D.L. Double–blind comparison of single doses of DS103–282, baclofen and placebo for suppression of spasticity. //J. Neurol. Neurosurg. Psychiatry. –1980. –Vol.43, N.12. –P.1132–1136
32. Jentsch J.D., Taylor J.R. Impulsivity resulting from frontostriatal dysfunction in drug abuse: implications for the control of behavior by reward–related stimuli. //Psychopharmacol. –1999. –Vol.146. –P.373–390
33. Joseph F.G., Scolding N.J. Cerebral vasculitis: a practical approach. //Pract. Neurol. –2002. –Vol.2. –P.80–93
34. Mayer N.H. Spasticity and the stretch reflex. //Muscle & Nerve. –1997. –Vol.20, Suppl.6. –P.S1–S13
35. Miettinen T.J., Kanto J.H., Salonen M.A., Scheinin M. The sedative and sympatholytic effects of oral tizanidine in healthy volunteers. //Anesth. Analg. –1996. –Vol.82, N.4. –P.817–820
36. Moore P.M., Richardson B. Neurology of the vasculitides and connective tissue diseases. //J. Neurol. Neurosurg. Psychiatry. –1998. –Vol.65. –P.10–22
37. Nance P.W., Sheremata W.A., Lynch S.G. et al. Relationship of the antispasticity effect of tizanidine to plasma concentration in patients with multiple sclerosis. //Arch. Neurol. –1997. –Vol.54, N.6. –P.731–736
38. Siva A. Vasculitis of the nervous system. //J. Neurol. –2001. –Vol.248. –P.451–468
39. Stein R., Nordal H.J., Oftedal S.I., Slettebo M. The treatment of spasticity in multiple sclerosis: a double–blind clinical trial of a new anti–spastic drug tizanidine compared with baclofen. //Acta Neurol. Scand. –1987. –Vol.75, N.3. –P.190–194
40. Verdejo–Garcia A., Lopez–Torrecillas F., Gimenez C.O., Perez–Garcia M. Clinical implications and methodological challenges in the study of the neuropsychological correlates of cannabis, stimulant, and opioid abuse. //Neuropsychol. Rev. –2004. –Vol.14, N.1. –P.1–41
41. Wagstaff A. J., Bryson H.M. Tizanidine. A review of its pharmacology, clinical efficacy and tolerability in the management of spasticity associated with cerebral and spinal disorders. //Drugs. –1997. –Vol.53, N.3. –P.435–452
42. Wiesendanger M. Neurobiology of spasticity. //In: Spasticity: The current status of research and treatment. Ed. by M.Emre, R.Benecke. –Carnforth etc.: The Parthenon Publishing Group, 1989. –P.45–61
43. Wiesendanger M., Palmeri A., Corboz M. Some pathophysiological considerations about muscle tone and spasticity. //In: The origin and treatment of spasticity. Ed. by R.Benecke et al. –Carnforth etc.: The Parthenon Publishing Group, 1990. –P.15–27
44. Winkler P.A. Assessment tools in the management of spasticity: Perspective from physical therapy. /In: Physiology and Management of Spasticity. Ed. C.O’Brien. –Deerfield: Discovery International, 1996. –P.3–14
45. Yatsu F.M., Grotta J.C., Pettigrew L.C. Stroke: 100 Maxims. –St. Louis etc.: Mosby, 1995
46. Young R.R. Spasticity: a review. //Neurology. –1994. –Vol.44 (Supp.9). –P.S12–S20
Парфенов В.А.
Московская медицинская академия им. И.М. Сеченова
Актуальность проблемы
В России ежегодно регистрируется 300-400 тысяч инсультов, что приводит к наличию более одного миллиона больных, перенесших инсульт. Более чем у половины из них остаются двигательные нарушения, вследствие которых существенно снижается качество жизни и нередко развивается стойкая инвалидность (1).
Двигательные нарушения после перенесенного инсульта чаще всего проявляются гемипарезом или монопарезом конечности с повышением мышечного тонуса по типу спастичности (1,2,9). У больных инсультом спастичность обычно нарастает в паретичных конечностях в течение нескольких недель и месяцев, сравнительно редко (чаще всего при восстановлении двигательных) функций наблюдается спонтанное уменьшение спастичности. Во многих случаях у больных инсультом спастичность ухудшает двигательные функции, способствует развитию контрактуры и деформации конечности, затрудняет уход за обездвиженным больным и иногда сопровождается болезненными мышечными спазмами (2,5,6,9,14).
Восстановление утраченных двигательных функций максимально в течение двух-трёх месяцев с момента инсульта, в дальнейшем темпы восстановления снижаются значительно. Через год после развития инсульта мало вероятно уменьшение степени пареза, однако возможно улучшение двигательных функций и уменьшение инвалидности путём тренировки равновесия и ходьбы, использования специальных приспособлений для передвижения и снижения спастичности в паретичных конечностях (1,2,6,9,14)
Основная цель лечения постинсультной спастичности состоит в улучшении функциональных возможностей паретичных конечностей, ходьбы, самообслуживания больных. К сожалению, в значительной части случаев возможности лечения спастичности ограничиваются только уменьшением боли и дискомфорта, связанного с высоким мышечным тонусом, облегчением ухода за парализованным пациентом или устранением имеющегося косметического дефекта, вызванного спастичностью (2,6,14).
Один из наиболее важных вопросов, который приходится решать при ведении больного с постинсультной спастичностью сводится к следующему: ухудшает или нет спастичность функциональные возможности больного? В целом, функциональные возможности конечности у больного с постинсультным парезом конечности хуже при наличии выраженной спастичности, чем при её лёгкой степени. Вместе с тем у части больных при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а её снижение привести к ухудшению двигательной функции и даже к падениям (2,6,14).
Перед тем, как начать лечить постинсультную спастичность, необходимо определить возможности лечения у конкретного больного (улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за пациентом и др.) и обсудить их с больным и (или) его родственниками. Возможности лечения во многом определяются сроками с момента заболевания и степенью пареза, наличием когнитивных расстройств (2,6,14). Чем меньше сроки с момента развития инсульта, вызвавшего спастический парез, тем более вероятно улучшение от лечения спастичности, потому что оно может привести к существенному улучшению двигательных функций, предотвратив формирование контрактур и повысив эффективность реабилитации в период максимальной пластичности центральной нервной системы. При длительном сроке заболевания менее вероятно существенное улучшение двигательных функций, однако можно значительно облегчить уход за больным и снять дискомфорт, вызванный спастичностью. Чем меньше степень пареза в конечности, тем более вероятно, что лечение спастичности улучшит двигательные функции (14).
Лечебная гимнастика
Лечебная гимнастика представляет наиболее эффективное направление ведения больного с постинсультным спастическим гемипарезом, она направлена на тренировку движений в паретичных конечностях и предотвращение контрактур (2,14).
В качестве методов физиотерапии используются лечение положением, обучение пациентов стоянию, сидению, ходьбе (с помощью дополнительных средств и самостоятельно), бинтование конечности, применение ортопедических аппаратов, тепловые воздействия на спастичные мышцы, а также электрическая стимуляция определенных мышечных групп, например разгибателей пальцев кисти или передней большеберцовой мышцы (4).
Больным, имеющим выраженную спастичность в сгибателях верхних конечностей, не следует рекомендовать интенсивные упражнения, которые могут значительно усилить мышечный тонус, например, сжимание резинового кольца или мяча, использование экспандера для развития сгибательных движений в локтевом суставе.
Массаж мышц паретичных конечностей, имеющих высокий мышечный тонус, возможен только в виде легкого поглаживания, напротив, в мышцах антогонистах, можно использовать растирание и неглубокое разминание в более быстром темпе.
Иглорефлексотерапия относительно часто используется в нашей стране в комплексной терапии больных, имеющих постинсультный спастический гемипарез, однако контролируемые исследования, проведенные за рубежом, не показывают существенной эффективности этого метода лечения (10).
Миорелаксанты
В качестве лекарственных средств, принимаемых внутрь для лечения постинсультной спастичности, в клинической практике используются преимущественно баклофен и тизанидин (5-7). Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и вследствие этого предупредить развитие контрактур. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты (2,5-7,14). Лечение миорелаксантами начинают с минимальной дозы, затем её медленно повышают для достижения эффекта. Антиспастические средства обычно не комбинируют.
Баклофен (Баклосан) оказывает антиспастическое действие преимущественно на спинальном уровне.
Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК); он связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделению возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности.
За свою долгую историю остается препаратом выбора в лечении спастичности спинального и церебрального происхождения.
Баклофен оказывает также центральное анальгезирующее действие и оказывает противотревожный эффект. Он хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови достигается через 2-3 часа после приёма. Баклофен (баклосан) используется при спинальной (спинальная травма, рассеянный склероз) и церебральной спастичности; он эффективен при болезненных мышечных спазмах различного генеза. Баклофен (Баклосан) Начальная доза составляет 5-15 мг в сутки (в один или три приёма), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта, препарат принимают во время еды. Максимальная доза баклофена (баклосана) для взрослых составляет 60-75 мг в сутки. Побочные эффекты проявляются сонливостью, головокружением в начале лечения, хотя они имеют четко дозозависимый характер и в дальнейшем могут ослабевать. Иногда возникают тошнота, запор, диарея, артериальная гипотония.
Баклофен можно использоваться интратекально с помощью специальной помпы при спастичности, вызванной различными неврологическими заболеваниями, включая последствия инсульта (8,11,13). Использование баклофеновой помпы в сочетании с лечебной гимнастикой, физиотерапией может улучшить скорость и качество ходьбы у больных с постинсультной спастичностью, способных к самостоятельному передвижению (8). Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств (13). Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт (11). Тизанидин – миорелаксант центрального действия, агонист альфа-2 адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Препарат обладает также умеренным центральным анальгезирующим действием, эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2-6 мг в сутки в один или три приёма, средняя терапевтическая доза – 12-24 мг в сутки, максимальная доза – 36 мг в сутки. В качестве побочных эффектов могут отмечаться выраженная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления.
Ботулинический токсин
У больных, перенесших инсульт и имеющих локальную спастичность в паретичных мышцах, можно использовать ботулинический токсин типа А или ботулотоксин (ботокс, диспорт). Использование ботулинического токсина показано, если у больного, перенесшего инсульт, имеется мышца с повышенным тонусом без контрактуры, а также отмечаются боль, мышечные спазмы, снижение объёма движений и нарушение двигательной функции, связанные со спастичностью этой мышцы (2-4,12,14). Действие ботулинического токсина при внутримышечном введении вызвано блокированием нервно-мышечной передачи, обусловленным подавлением высвобождения нейромедиатора ацетилхолина в синаптическую щель.
Клинический эффект после инъекции ботулинического токсина отмечается спустя несколько дней и сохраняется в течение 2-6 месяцев, после чего может потребоваться повторная инъекция. Лучшие результаты отмечаются при использовании ботулинического токсина в ранние сроки (до года) с момента заболевания и легкой степени пареза конечности. Применение ботулинического токсина может быть особенно эффективно в тех случаях, когда имеется эквино-варусная деформация стопы, вызванная спастичностью задней группы мышц голени, или высокий тонус мышц сгибателей запястья и пальцев, ухудшающий двигательную функцию паретичной руки (14). В контролированных исследованиях доказана эффективность диспорта при лечении постинсультной спастичности в руке (3).
В качестве побочных эффектов от использования ботулотоксина могут быть кожные изменения и боли в месте инъекции. Они обычно самостоятельно регрессируют в течение нескольких дней после инъекции. Возможна значительная слабость мышцы, в которую введён ботулотоксин, а также слабость в мышцах, расположенных близко к месту инъекции, локальная вегетативная дисфункция. Однако мышечная слабость обычно компенсируется деятельностью агонистов и не приводит к ослаблению двигательной функции. Повторные инъекции ботулотоксина у части больных дают менее значительный эффект, что связывается с образованием антител к ботулотоксину и блокированием его действия. Ограничение широкого применения ботулинического токсина в клинической практике во многом вызвано его высокой стоимостью.
Хирургические методы лечения
Хирургические операции для уменьшения спастичности возможны на четырёх уровнях - на головном мозге, спинном мозге, периферических нервах и мышцах (2,14). У больных с постинсультной спастичностью они используются редко. Эти методы чаще применяются при детском церебральном параличе и спинальной спастичности, вызванной спинальной травмой.
Хирургические операции на головном мозге включают электрокоагуляцию бледного шара, вентролатерального ядра таламуса или мозжечка и имплантацию стимулятора на поверхность мозжечка. Эти операции используются редко и имеют определённый риск осложнений.
На спинном мозге может быть проведено продольное рассечение конуса (продольная миелотомия) с целью разрыва рефлекторной дуги между передними и задними рогами спинного мозга. Операция применяется при спастичности нижних конечностей, она технически сложна и связана с высоким риском осложнений, поэтому используется редко. Шейная задняя ризотомия может привести к снижению спастичности не только в верхних конечностях, но и в нижних, однако выполняется редко из-за риска осложнений. Селективная задняя ризотомия представляет наиболее частое вмешательства среди операций на спинном мозге и его корешках, она обычно используется при спастичности в нижних конечностях на уровне от второго поясничного до второго крестцового корешка.
Рассечение периферических нервов может устранить спастичность, однако эта операция нередко осложняется развитием болей, дизестезий и нередко требует дополнительной ортопедической операции, поэтому используется редко.
Значительная часть хирургических операций у пациентов со спастичностью различного генеза проводится на мышцах или их сухожилиях. Удлинение сухожилия мышцы или перемещение мышцы уменьшает активность интрафузальных мышечных волокон, снижая тем самым спастичность. Эффект от операции сложно прогнозировать, иногда требуется несколько операций. При развитии контрактуры хирургическое вмешательство на мышцах или их сухожилиях нередко представляет единственный метод лечения спастичности.
Заключение
Лечение постинсультной спастичности представляет актуальную проблему современной неврологии. Ведущую роль в лечении постинсультной спастичности имеет лечебная гимнастика, которая должна начинаться уже с первых дней развития инсульта и быть направлена на тренировку утраченных движений, самостоятельное стояние и ходьбу, а также профилактику развития контрактур в паретичных конечностей.
В тех случаях, когда у больного с постинсультным парезом конечности имеется локальная спастичность, вызывающая ухудшение двигательных функций, можно использовать локальное введение препаратов ботулинического токсина.
В качестве лекарственных антиспастических средств, применяемых внутрь, рекомендуются Баклофен (Баклосан)
и тизанидин, которые способны уменьшить повышенный тонус, облегчить физиотерапевтические занятия, а также уход за парализованным больным. Одним из перспективных методов лечения посинсультной спастичности является введение баклофена интратекально с помощью специальной помпы, эффективность которого активно изучается в последние годы.
ЛИТЕРАТУРА
1. Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. Нарушения кровообращения в головном и спинном мозге. В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н.Н. Яхно. М.: Медицина, 2005, Т.1., С. 232-303.
2. Парфенов В.А.. Спастичность В кн.: Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / Под ред. О.Р. Орловой, Н.Н. Яхно. – М.: Каталог, 2001 – С. 91-122.
3. Bakheit A.M., Thilmann A.F., Ward A.B. et al. A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke // Stroke. – 2000. – Vol. 31. – P. 2402-2406.
4. Bayram S., Sivrioglu K., Karli N. Et al. Low-dose botulinum toxin with short-term electrical stimulation in poststroke spastic drop foot: a preliminary study // Am J Phys Med Rehabil. – 2006. - Vol. 85. – P. 75-81.
5. Chou R., Peterson K., Helfand M. Comparative efficacy and safety of skeletal muscle relaxants for spasticity and musculoskeletal conditions: a systematic review. // J Pain Symptom Manage. – 2004. – Vol. 28. – P.140–175.
6. Gallichio J.E. Pharmacologic management of spasticity following stroke. // Phys Ther 2004. – Vol. 84. – P. 973–981.
7. Gelber D. A., Good D. C., Dromerick A. et al. Open-Label Dose-Titration Safety and Efficacy Study of Tizanidine Hydrochloride in the Treatment of Spasticity Associated With Chronic Stroke // Stroke. – 2001. - Vol.32. – P. 1841-1846.
8. Francisco G.F., Boake C. Improvement in walking speed in poststroke spastic hemiplegia after intrathecal baclofen therapy: a preliminary study // Arch Phys Med Rehabil. – 2003. – Vol. 84. – P. 1194-1199.
9. Formisano R., Pantano P., Buzzi M.G. et al. Late motor recovery is influenced by muscle tone changes after stroke // Arch Phys Med Rehabil. – 2005. – Vol. 86. – P.308-311.
10. Fink M., Rollnik J.D., Bijak M. Et al. Needle acupuncture in chronic poststroke leg spasticity // Arch Phys Med Rehabil. - 2004. – Vol. 85. – P.667-672.
11. Ivanhoe C.B., Francisco G.E., McGuire J.R. et al. Intrathecal baclofen management of poststroke spastic hypertonia: implications for function and quality of life // Arch Phys Med Rehabil. – 2006. – Vol. 87. – P. 1509-1515.
12. Ozcakir S., Sivrioglu K. Botulinum toxin in poststroke spasticity // Clin Med Res. – 2007. – Vol. 5. – P.132-138.
13. Taira T., Hori T. Intrathecal baclofen in the treatment of post-stroke central pain, dystonia, and persistent vegetative state // Acta Neurochir Suppl. – 2007. – Vol.97. – P. 227-229.
14. Ward A.B. A summary of spasticity management – a treatment algorithm // Eur. J. Neurol. – 2002. – Vol. 9. – Suppl.1. – P. 48-52.
Снять спастику после инсульта оказалось чрезвычайно трудно. Дело в возникающем противоречии. Мы упёрто восстанавливали силу и выносливость. Делали это с помощью специальных упражнений с высокой нагрузкой и кучей повторений.
Для лечения спастики это помеха и вред. При снятии спастики нужен расслабляющий массаж и легкие движения в упражнениях. Что бы продолжить восстановление после инсульта надо проводить взаимоисключающие занятия. Но мы придумали простое решение. Сделать две группы занятий.
Первая: для восстановления силы и выносливости. Вторая для лечения спастики, восстановления равновесия и координации. Решение оказалось очень правильным. Правда мы допёрли до него не сразу и некоторое время делали упражнения для снятия спастики вместе с упражнениями на силу и выносливость. Вовремя заметили, что от активных упражнений спастика усиливается.
Что из себя представляет спастика
Проявляется спастика в скованности. Невозможно сделать быстрое или резкое движение. Постоянно напряженные мышцы блокируют свободу
. Чувство словно ты сильно заржавевший Терминатор))).
Напряжение приводит к скорой утомляемости.
Восстановление после инсульта может быть фактически заблокировано спастикой. Трудно восстанавливать навыки, когда конечности словно связаны резинками и всегда находятся в напряженном, неестественном положении. Для снятия спастики после инсульта мы применяем элементарные упражнения. Главное делать их легко, без напряжения.
Спастика мышц — это непроизвольное их сокращение, судороги или спазм вследствие нарушения проводимости нервных импульсов после травмы спинного и головного мозга.
Чаще это состояние проявляется ночью, но так же может существенно затруднить жизнь днем.
Механизм образования спастичности
Основной причиной формирования судорог специалисты называют дисбаланс тормозного влияния двигательных элементов коры головного на клетки в структуре спинного мозга.
Закономерным итогом становится растормаживание тонического рефлекса – формируется мышечная спастика в пораженных травмой конечностях человека.
В нормальном состоянии человеку не приходиться задумываться об очередности производимых в мышцах явлениях: какие из них сначала требуется сократить, затем расслабить – наш мозг довел подобную деятельность до автоматизма.
После инсульта или травмы происходит гибель клеточных элементов, несущих ответственность за специальные тормозящие импульсы в двигательных нейронах головного и спинного мозга. Рефлекторная дуга: конечность – спинной мозг – головной мозг перестает быть единой системой – происходит нарушение координации.
Спазмы формируются далеко не сразу – на протяжении недель , и даже месяцев. Приводит к значительным вторичным изменениям в мышцах и суставах – усиливает отрицательное воздействие парезов на двигательную систему.
Степень выраженности спастики конечностей
Первые признаки начала формирования спастики мышц наблюдаются в первые же сутки после травмы, а в последующем имеют тенденцию к усилению.
Изменяться степень выраженности может под неблагоприятным воздействием негативных факторов, к примеру:
- при изменении эмоциональной настроенности – наличии у человека склонности к депрессивным состояниям;
- при изменении погодных условий – колебание параметров температуры либо освещенности;
- при чрезмерной физической перегрузке, вызванной ранней физической активностью пострадавшего, вопреки рекомендациям врача.
При усилении интенсивности нагрузки на мышечные волокна в конечностях, происходит затруднение их двигательной активности, наблюдаются симптомы болевых ощущений в них, различной степени выраженности.
По степени выраженности спастики различают следующие формы:

Спастика ног в легкой форме проявляется быстрой утомляемостью мышц голеней, ощущение «забитости мышц», от физической деятельности, ходить при этом легче становится на каблуке, затем становится затруднительно потянуть к себе пальцы ног и разогнуть ее в колене.
В тяжелой форме спазма: одна или две ноги фиксируются в согнутом в коленном или тазобедренном суставах, а стопа выворачивается внутрь или наружу. При хождении без специальной обуви или , могут возникнуть деформации или контрактуры.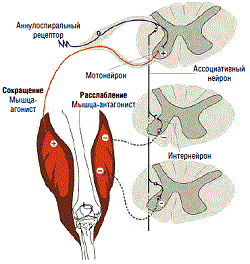
Проявление спастике рук в легкой форме: затруднено разгибание
пальцев и выпрямление руки в локтевом суставе, признаком тяжелой формы является согнутые в локтевом и плечевом суставах, кисть при этом сжата в кулак.
Если спастика присутствует долгое время без лечения, развивается контрактура, то есть сустав фиксируется не в физиологическом для организма состоянии.
В дальнейшем же, спазм будет иметь лишь отрицательное влияние на проведение восстановительных мероприятий. Помимо конечностей, будет ухудшать восстановление и в позвоночнике: повышение тонуса мышц вызывает болевые ощущения в спине – симптомы вертеброгенного радикулита.
Специалисты отмечают: чем раньше было начато адекватное лечение современными препаратами, а также, чем меньше выраженность спастики– тем лучше будет прогноз реабилитационных мероприятий.
Даже, если симптомы значительно выражены, а лечение судорог в силу определенных причин начались в более поздний временной промежуток – уменьшение спастики существенно улучшает общее самочувствие.
Как нужно лечить спастику разными методами
Наиболее важным требованием, предъявляемым к лечению, является его максимально возможная безболезненность, поскольку боль многократно усиливается спастикой.
Важным моментом является и контроль за деятельностью тазовых органов – предупреждение воспалительных проявлений в них, а также своевременно проводить мероприятия по предупреждению возникновения контрактур и .
 Комплекс современного лечения по избавлению от спастики:
Комплекс современного лечения по избавлению от спастики:
- лекарственная тактика (мидокалм, баклофен);
- методики;
- ортезирование;
- хирургическая коррекция.
Комплекс лечения подбирается только индивидуально, в прямой зависимости от локализации очага и степени выраженности спастики. Необходимо учитывать и технические возможности медицинского учреждения.
Спастика после инсульта или травмы головного мозга обязательно требует медикаментозного воздействия. Лечение должно проводиться поэтапно – с постепенным наращиванием лечебной дозы медикаментов, возможно заменой препарата.
 На сегодняшний день востребованы две подгруппы:
На сегодняшний день востребованы две подгруппы:
- Препараты с центральным механизмом воздействия на негативный очаг – торможение рефлекса.
- Препараты периферического воздействия – существенно снижают рефлекс растяжения на уровне элементов спинного мозга: миорелаксанты.
Как и у иных подгрупп даже самых современных препаратов, у вышеперечисленных имеют свои противопоказания, поэтому их назначением должен заниматься только высококвалифицированный специалист невролог.
Ортезирование и гипс
Лечение спастики длительной укладкой конечностей человека, в такое положение, когда мышцы оптимально растянуты, а тоническая рефлекторная активность уменьшена, именуется специалистами ортезированием. Оно способствует снижению гипертонуса в конечностях – патологические симптомы удается многократно уменьшить.
При выраженной спастике рекомендуется даже наложение специальной гипсовой лангеты либо шины – для предотвращения развития контрактуры. Именно шина фиксирует конечность в наиболее приемлемом положении — при котором мышечные волокна располагаются в растянутом положении.
Лечение ортезированием проводится от одного до двух часов, в прямой зависимости от ощущений человека – при усилении болевых ощущений, процедуру заканчивают.
Физиотерапия при скованности мышц
- локальное использование холода – способствует понижению чрезмерных рефлексов и максимальному увеличению объема движений, улучшению деятельности мышц;
- локальное использование тепла – отлично способствует временному понижению тонуса. осуществляется при помощи озокеритовых или парафиновых аппликаций, курс – не менее двадцати процедур;
- нервных окончаний – превосходная методика, позволяющая добиться максимального ответа в пораженных участках, продолжительность лечебного курса назначается специалистом.
ЛФК разработка
 Лечение с помощью упражнений, направленных на оптимальное расслабление волокон в мышцах – давно проверенный, успевший себя отлично зарекомендовать реабилитационный прием лечения спастики.
Лечение с помощью упражнений, направленных на оптимальное расслабление волокон в мышцах – давно проверенный, успевший себя отлично зарекомендовать реабилитационный прием лечения спастики.
Дозированное лечебное растягивание позволяет на пару часов понизить их тонус, максимально увеличить объем движений в пораженных конечностях.
Кинезиотерапевт знает, что снижение тонуса будет наблюдаться лишь определенное время а потому его необходимо эффективно использовать для проведения иных комплексных упражнений, которые были затруднены из-за спастики.
Хирургическое вмешательство определяется специалистом по строго индивидуальным показаниям, когда консервативные методики уже исчерпали себя, а выраженной положительной динамики не наблюдается.
Снять спастику задача важная. Она сильно мешает в повседневной жизни, отнимает силы и сковывает движения. Это мешает восстанавливать утраченные навыки и выносливость. Чтобы полноценно проводить восстановление после инсульта, нужно обязательно вылечить спастику. Мы это выполняем параллельно с остальными задачами.
При комплексном подходе и начале лечебных мероприятий на возможно более раннем этапе, медикаментозного лечения – нормализация мышечного тонуса способствует максимальному ускорению восстановления больного.
В лечении хорошо себя показали такие методы как, миостимуляция,ботокс, конечно лечебная гимнастика, медицинские препараты(мидокалм, баклофен) и щадящая хирургия.
Что такое, причины возникновения спастичности, недопущение и лечение обновлено: Ноябрь 21, 2017 автором: автор
Для цитирования:
Широков Е.А. Инсульт и мышечный гипертонус // РМЖ. 2011. №15. С. 963
Острые нарушения мозгового кровообращения (ОНМК) составляют одну из наиболее актуальных проблем современной медицины. Число больных, перенесших инсульт, в РФ увеличивается и в настоящее время превышает 1 млн. человек . Наиболее значительные последствия сосудистых мозговых катастроф связаны с нарушениями движений. Парезы и параличи, нарушения координации движений требуют комплексных реабилитационных мероприятий, направленных на восстановление навыков самообслуживания и социальной адаптации. Восстановление утраченных двигательных функций происходит довольно активно в течение первых месяцев после мозгового удара, в дальнейшем темпы восстановления снижаются. Как правило, уже первые недели восстановительного периода характеризуются заметным уменьшением степени пареза, увеличением силы и объема движений. Однако в этот период у многих больных возникает другая проблема - нарушения мышечного тонуса. Нарас-тает спастичность (С), которая существенно ограничивает результаты реабилитации и нередко становится препятствием к восстановлению двигательной активности. Тонус повышается в разных мышцах в различной степени. Это приводит к тому, что рука приобретает устойчивое положение со сгибанием в локтевом суставе и лучезапястном суставе. Нога при центральных параличах, важным признаком которых является гипертонус, напротив, чаще всего оказывается разогнутой. Спастичность приводит не только к формированию устойчивых патологических поз, но и способствует патологическим изменениям в суставах. Как правило, больные страдают от артрозов и анкилозов, болей в суставах не меньше, чем от парезов.
Развитие С при повреждениях структур центральной нервной системы связывают со снижением тормозных влияний на спинальные мотонейроны . Сни-жение тормозных влияний на спинальные структуры объясняется комбинированным поражением пирамидных и экстрапирамидных путей головного мозга, при этом важную роль в развитии спастичности отводят повреждению кортико-ретикуло-спинального тракта . В условиях ослабления кортикоспинальных стимулов, как правило, можно наблюдать и дисфункцию экстрапирамидной системы. Одним из ведущих механизмов формирования С следует считать растормаживание тонического рефлекса растяжения. Возникающие при мышечной гипертонии вторичные изменения в мышцах, сухожилиях и суставах усиливают двигательные расстройства, в связи с этим сопротивление пассивному движению зависит не только от нарушений мышечного тонуса, но и от изменений мышц, в которых часто можно обнаружить признаки атрофии. Изолиро-ван-ное поражение пирамидного пути, как правило, не вызывает гипертонуса, а приводит лишь к парезу. Однако при ОНМК обычно возникает поражение не только пирамидного пути, но и других структур, таких как кортико-ретикуло-спинальный тракт, что и приводит к неизбежным нарушениям мышечного тонуса. Если постинсультный парез сохраняется в течение длительного времени (несколько месяцев и более), то могут возникнуть структурные изменения сегментарного аппарата спинного мозга (укорочение дендритов мотонейронов и коллатеральный спрутинг афферентных волокон, входящих в состав задних корешков), которые способствуют устойчивой перестройке двигательного стереотипа . Этому способствуют вторичные изменения в мышцах, сухожилиях и суставах, которые усиливают сопротивление, возникающее в мышце при ее растяжении . Знания о патогенезе тонических расстройств, возникающих в связи с ОНМК, необходимы для понимания механизмов действия лекарств, большинство из которых имеют так называемый центральный механизм действия.
Обнаружить первые признаки нарастающих мышечно-тонических расстройств удается уже в первые часы после инсульта. Нередко они характеризуются снижением мышечного тонуса. Однако через несколько дней спастичность становится заметной и нарастает вместе с восстановлением движений. Функци-ональ-ное состояние мускулатуры, мышечный тонус оцениваются при стандартном неврологическом осмотре больного, в процессе наблюдения за активными движениями, при пассивных изменениях положения в пространстве частей тела. Спастичность характеризуется повышением мышечного тонуса, препятствующим расширению объема движений. Каждый раз при выполнении простейших движений больному приходится преодолевать сопротивление напряженных мышц, что усугубляет картину пареза или паралича. Характерным клиническим признаком С является ее изменение в процессе исследования - тонус возрастает при пассивном растяжении мышцы, причем увеличение мышечного сопротивления напрямую зависит от скорости пассивного движения. Частым признаком, выявляющим дистонию, является неравномерность мышечного тонуса во время сгибания и разгибания конечности - феномен «складного ножа». Степень нарушений мышечного тонуса может существенно изменяться в течение дня, под влиянием внешних и внутренних факторов (погоды, эмоционального состояния больного, температуры окружающей среды). Для больных, перенесших инсульт, характерно изменение тонуса в зависимости от положения конечности, физической нагрузки, ее характера и интенсивности. Гипертонус может задержать восстановление после инсульта, поскольку при выраженных мышечных дистониях повседневная активность больного ограничивается пределами постели: при любых попытках перейти в вертикальное положение - стойкое напряжение мышц препятствует перемещению и заставляет больного вновь вернуться в горизонтальное положение. Возникают и другие осложнения постинсультного периода — ограничение подвижности в суставах, артроз-артриты и связанные с ними болевые синдромы. Мышечная дистония оказывает существенное влияние на статику позвоночника, что в некоторых случаях становится самостоятельной проблемой (люмбалгии, торакалгии, вертеброгенные радикулопатии). Один из наиболее важных вопросов, который приходится решать при ведении пациента с постинсультной спастичностью, сводится к следующему: ухудшает или нет высокий мышечный тонус функциональные возможности пациента? В целом функциональные возможности конечности у пациентов с постинсультным парезом конечности хуже при наличии выраженной спастичности, чем при ее легкой степени. Вместе с тем у части пациентов при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а ее снижение привести к ухудшению двигательной функции и даже падениям . Перед тем как начать коррекцию гипертонуса, необходимо определить возможности лечения в данном конкретном случае (улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за пациентом и др.) и обсудить их с пациентом и (или) его родственниками. Возможности лечения во многом определяются сроками с момента заболевания и степенью пареза, наличием когнитивных расстройств . Чем меньше сроки с момента инсульта, вызвавшего спастический парез, тем более вероятно улучшение. При длительном сроке заболевания менее вероятно существенное улучшение двигательных функций, однако можно значительно облегчить уход за больным и снять дискомфорт, вызванный С. Чем меньше степень пареза в конечности, тем более вероятно, что лечение улучшит двигательные функции . Для клинической оценки мышечного тонуса и контроля эффективности лечения в практических целях используется модифицированная шкала Эшуорта (табл. 1).
Принципы коррекции спастичности в постинсультом периоде основаны на следующих положениях:
- патологически повышенный тонус мышц следует снижать во всех случаях для предупреждения необратимых изменений в мышцах и суставах и ускорения процесса реабилитации;
- лечение необходимо начинать как можно раньше, при появлении первых признаков С;
- длительность лечения определяется восстановлением двигательной активности больного.
Лекарственная терапия мышечных дистоний у больных, перенесших инсульт, основана на применении миорелаксантов. Перед назначением миорелаксантов необходимо установить, насколько повышение мышечного тонуса затрудняет движения. В некоторых случаях (особенно в раннем восстановительном периоде) гипертонус помогает больному сохранять опору на паретичную конечность - тогда назначение миорелаксантов может быть отсрочено. Однако эта особенность, как правило, требует внимания в течение короткого периода времени - во время первых попыток больного восстановить навыки ходьбы. В дальнейшем снижение мышечного тонуса играет более важную роль в программах комплексной реабилитации, поскольку позволяет расширить объем движений.
Чаще всего для лечения спастических синдромов используется толперизон. По своей химической структуре препарат близок к лидокаину. В основе действия лекарства — блокада полисинаптических спинномозговых рефлексов. Кроме того, препарат оказывает центральное холинолитическое действие, обладает спазмолитической и умеренной сосудорасширяющей активностью. Толперизон снижает повышенный мышечный тонус и ригидность мышц при спастических парезах, улучшает произвольные активные движения, нормализует периферическое кровообращение, обладает мембраностабилизирующим, местноанестезирующим действием. Его применение в адекватных дозах приводит к усилению местного кровообращения. Основным противопоказанием к применению является миастения и непереносимость лидокаина. Обычно начало лечения приходится на 2-3-ю неделю инсульта - период активизации больного. При появлении первых признаков спастичности назначают 50-100 мг препарата в сутки, что в большинстве случаев облегчает движения. В более поздние периоды заболевания, с формированием стойких спастических парезов, требуются и более высокие дозы миорелаксантов. В тяжелых случаях нарастающей спастичности используется внутримышечное введение препарата по 100 мг 2 раза в сутки. Таблетки по 50 и 150 мг позволяют действовать в широком диапазоне терапевтических доз для достижения необходимого эффекта. Сосудорасширяющее действие толперизона может оказаться полезным при выраженных атеросклеротических изменениях сосудов нижних конечностей. Пре-парат хорошо сочетается с нестероидными противовоспалительными средствами. Важно отметить, что препарат не вызывает общей мышечной слабости. Седатив-ным эффектом толперизон не обладает.
Для коррекции спастичности различного генеза используются и другие средства: тизанидин, баклофен, дантролен и бензодиазепины. Основанием для применения этих антиспастических средств (или миорелаксантов) служат результаты двойных слепых плаце-бо-контролируемых рандомизированных исследований, показавших безопасность и эффективность этих лекарственных средств . Анализ исследований, посвященных сравнению использования различных антиспастических средств при разнообразных неврологических заболеваниях, сопровождающихся спастичностью, показал, что тизанидин, баклофен и диазепам примерно в одинаковой степени способны уменьшить спастичность .
У пациентов, перенесших инсульт и имеющих локальную спастичность в паретичных мышцах, можно использовать ботулинический токсин типа А или ботулотоксин. Действие ботулинического токсина при внутримышечном введении вызвано блокированием нерв-но-мы-шечной передачи. Клинический эффект после инъекции ботулинического токсина отмечается спустя несколько дней и сохраняется в течение 2-6 месяцев, после чего может потребоваться повторная инъекция. Лучшие результаты отмечаются при использовании ботулинического токсина в ранние сроки (до года) с момента заболевания и при легкой степени пареза конечности. Применение ботулинического токсина может быть особенно эффективно в тех случаях, когда имеется деформация стопы, вызванная спастичностью задней группы мышц голени, или высокий тонус мышц сгибателей запястья и пальцев, ухудшающий двигательную функцию паретичной руки . Повторные инъекции ботулотоксина у части больных дают менее значительный эффект, что связывается с образованием антител к ботулотоксину и блокированием его действия. Ограничение широкого применения ботулинического токсина в клинической практике во многом вызвано высокой стоимостью препарата.
Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта. Антиспастические средства обычно не комбинируют.
Возможно и хирургическое пособие при постинсультной спастичности. Хирургические операции для уменьшения спастичности возможны на четырех уровнях - на головном мозге, спинном мозге, периферических нервах и мышцах . Хирургические операции на головном мозге включают электрокоагуляцию бледного шара, вентролатерального ядра таламуса или мозжечка и имплантацию стимулятора на поверхность мозжечка. На спинном мозге может быть проведено продольное рассечение конуса (продольная миелотомия) с целью разрыва рефлекторной дуги между передними и задними рогами спинного мозга. Опера-ция применяется при спастичности нижних конечностей, она технически сложна, связана с высоким риском осложнений, а поэтому используется редко. Зна-чи-тельная часть хирургических операций у пациентов со спастичностью различного генеза проводится на мышцах или их сухожилиях. При развитии контрактуры хирургическое вмешательство на мышцах или их сухожилиях нередко представляет единственный метод лечения спастичности.
Итак, лекарственная коррекция мышечных дистоний проводится в основном миорелаксантами, но в необходимых случаях для снижения мышечного тонуса возможно применение представителей других лекарственных групп, действующих на разные уровни патологического процесса. В каждом конкретном случае схема лечения и дозы лекарственных средств определяются индивидуально.
Необходимо отметить, что коррекция мышеч-но-тонических нарушений достигается комплексным лечением, которое включает правильно организованную и систематичную лечебную физкультуру, массаж, рефлексотерапию . Больным, перенесшим инсульт, обычно рекомендуются упражнения нескольких видов. Исполь-зу-ются так называемые общетонизирующие и дыхательные упражнения (способствующие улучшению общего состояния организма), упражнения для улучшения координации и равновесия, для восстановления силы парализованных мышц, а также приемы для уменьшения мышечного тонуса. Наряду с лечебными упражнениями используют также укладки или лечение положением, при котором больного специальным образом укладывают в постели так, чтобы создать наилучшие условия для восстановления функций его руки и ноги .
Литература
1. Гусев ЕИ. Проблема инсульта в России. Журнал неврологии и психиатрии им. С.С.Корсакова (ИНСУЛЬТ приложение к журналу).2003; 9: 3-7.
2. Парфенов В.А. Спастичность в кн.: Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей. Под ред. О.Р. Орловой, Н.Н. Яхно. - М.: Каталог, 2001 - с. 108-123.
3. Formisano R., Pantano P., Buzzi M.G. et al. Late motor recovery is influenced by muscle tone changes after stroke // Arch Phys Med Rehabil. - 2005; 86: 308-11.
4. Широков Е.А. Сирдалуд в комплексной терапии хронических болевых синдромов//РМЖ, 2006; 4:240-242.
5. Coward D.M. Tizanidine: Neuropharmacology and mechanism of action. //Neurology. 1994;11 (9): S6-S11.
6. Хатчинсон Д.Р. Тизадинин с модифицированным высвобождением (обзор).//РМЖ, 2007;12: 1- 4.
7. Кадыков А.С. Реабилитация после инсульта. М.: Издательство «Миклош». - 176 с.
8. Gelber D. A., Good D. C., Dromerick A. et al. Open-Label Dose-Titration Safety and Efficacy Study of Tizanidine Hydrochloride in the Treatment of Spasticity Associated With Chronic Stroke // Stroke. 2001; 32: 2127-31.
9. Камчатнов П.Р. Спастичность — современные подходы к терапии. http://www.medlinks.ru/article.php?sid=20428
10. Bakheit A.M., Thilmann A.F., Ward A.B. et al. A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke // Stroke. 2000; 31: 2402-06.
11. Francisco G.F., Boake C. Improvement in walking speed in poststroke spastic hemiplegia after intrathecal baclofen therapy: a preliminary study // Arch Phys Med Rehabil. 2003; 84: 1194-9.
12. Ward A.B. A summary of spasticity management - a treatment algorithm // Eur. J. Neurol. 2002; 9(1): 48-52.






